CONTACT
BLOG
2025.8.14
技術情報
めっきを行うには、表面に皮膜として形成したい金属 (素地も金属である場合に区別できるよう仮に「めっき金属」と呼びます)が、 溶媒(めっきでは水)の中に溶けていなければなりません(*1)。 「金属が水に溶けている」とは一体どういうことなのでしょうか。 銅めっきに使われる硫酸銅を例に考えてみましょう。 めっきに使われる硫酸銅(硫酸銅(Ⅱ))は、高校の化学の実験でも使われた、 あの青い結晶(*2)や白い粉です。 CuSO4 (白い粉:無水物) 硫酸銅の Cu2+と SO42- とはイオン結合で結ばれていますが、 水分子と出会うと、Cu2+ は SO42-とのイオン結合を解いて、 より安定に、水分子に囲まれることを選びます。 [Cu・(H2O)6]2+ (*3) 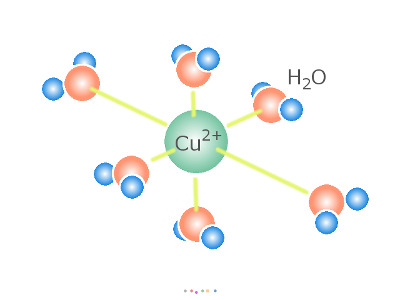
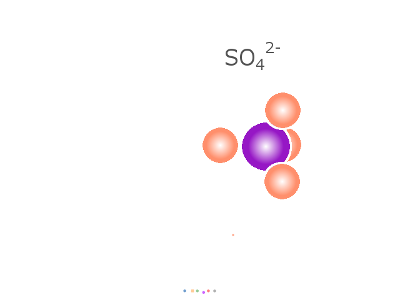 全体の反応式はこうです。 CuSO4+6H2O → [Cu・(H2O)6]2++SO42- 式中の・は水和(配位結合/水素結合/静電的作用などの力で水分子と結合する現象)を示します。 水分子は、Cu2+ イオンをとり囲んで水の中に分散させるように働いています。 これが「硫酸銅が水に溶ける」ということです。 「溶かす」こと以外には反応にあまり関与しない H2O を省略し、 次のような電離式もよく用いられています。 CuSO4 → Cu2++SO42- (*4) めっきを含めた多くの化学反応では、この6つの H2O を脱落させながら Cu2+ イオンは反応に参加します。 このような溶液中に Cu2+ イオンを供給し、一方で素地金属上に その Cu2+ イオンを析出させ皮膜を形成するのが銅めっきです。
全体の反応式はこうです。 CuSO4+6H2O → [Cu・(H2O)6]2++SO42- 式中の・は水和(配位結合/水素結合/静電的作用などの力で水分子と結合する現象)を示します。 水分子は、Cu2+ イオンをとり囲んで水の中に分散させるように働いています。 これが「硫酸銅が水に溶ける」ということです。 「溶かす」こと以外には反応にあまり関与しない H2O を省略し、 次のような電離式もよく用いられています。 CuSO4 → Cu2++SO42- (*4) めっきを含めた多くの化学反応では、この6つの H2O を脱落させながら Cu2+ イオンは反応に参加します。 このような溶液中に Cu2+ イオンを供給し、一方で素地金属上に その Cu2+ イオンを析出させ皮膜を形成するのが銅めっきです。 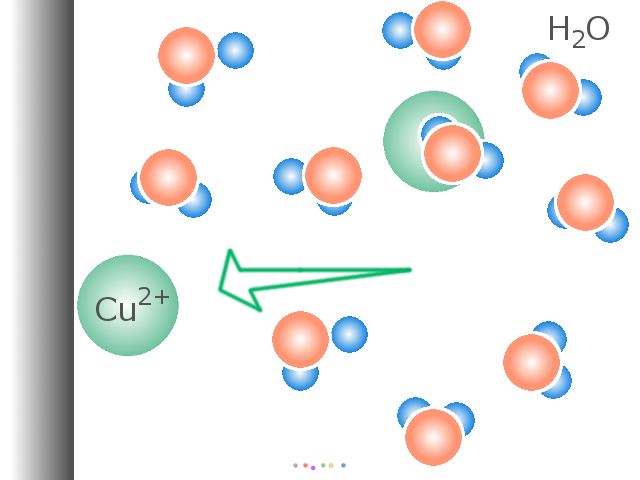
一般的に、溶液の入れ物を「めっき槽」、 あまり正確ではありませんがめっきに用いる単独または混合された溶液を 「めっき液」、何種類もの溶液が混合され実際にめっきができる状態に 調整されたものを特に「めっき浴」と呼びます。
青い結晶は5水和物で、 CuSO4・5H2O または構造から、 [Cu(H2O)4]SO4H2O と表せます。 Cu と4つの H2O の O との間は配位結合、 Cu と SO4 の O との間はイオン結合、 その SO44の2つの O と 1つの H2O の H との間は水素結合であり、 … OSO – Cu – OSO – Cu …を軸とした、歪んだ鎖状構造の結晶です。
6つのうち2つの水分子は、Cu から見て他の4つよりも遠くに (弱い)配位結合をとります。 したがってこれを、4配位(テトラアクア銅(Ⅱ)イオン)に 2つの比較的弱い水和が加わったもの、とする考え方もあるようです。
実際にはここからさらに、銅イオンは水の 水酸化物イオンによって 一部水酸化銅となっており(その電離度が1ではない)、 相対的に多くなった水素イオンによって硫酸銅水溶液は弱酸性を示します。 Cu2++2OH– ⇄ Cu(OH)2